8月1日,NMPA(国家药品监督管理局)公布国药监械注〔2019〕33号《国家药监局关于扩大医疗器械注册人制度试点工作的通知》,将注册人试点从原来的上海,后来的天津、广东到现在21个省份(含直辖市),全国目前就剩下山西、江西、甘肃、贵州、吉林、青海、内蒙古、新疆、西藏和宁夏(10个省市,香港、澳门和台湾目前不归NMPA管辖,未计入),见下图。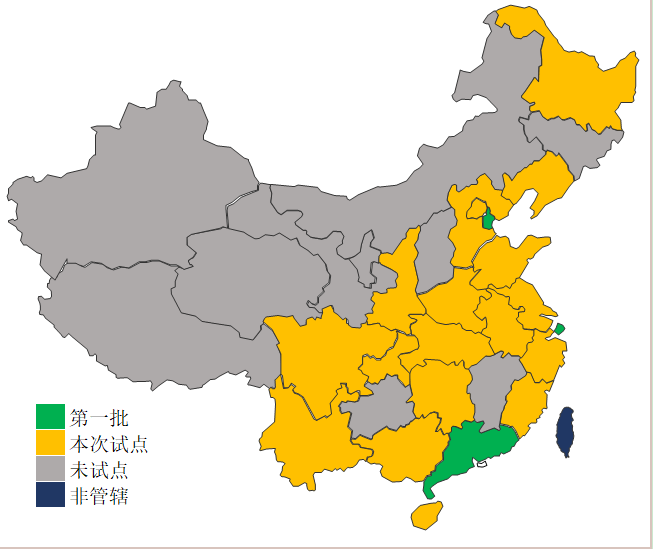
注册人制度简单说就是医疗器械注册证和生产许可证可以落在两个不同的主体上(注册证持有人对医疗器械质量负责),以推动医疗器械创新和研发,有点“术有专攻”的意味。这个对集团型企业、研究所、孵化器带来重大利好。在生产端,医疗器械行业的集中化趋势会越来越明显。
试点扩大后,后面就看试点地方的管理制度出台了。心急的可以参考一下上海、天津和广东的试点制度。
回顾一下历史:
2019男4月19日 医疗器械注册人制度试点工作座谈会在沪召开,19个省市参与
2018年8月20日 关于印发《广东省医疗器械注册人制度试点工作实施方案》的通知 (国家局网站上没找到)
2018年8月14日 国药监函〔2018〕43号 天津试点开始
2018年1月5日 2018年第1号公告 上海开展医疗器械注册人制度试点工作
2017年10月8日 中办国办印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),明确提出推动上市许可持有人制度全面实施。
上海市“医疗器械注册人制度”的改革措施主要包括四项:
第一,允许医疗器械注册人直接委托上海市医疗器械生产企业生产产品和样品。这意味着当产品还在“孵化”阶段,就允许自贸区内医疗器械注册申请人委托生产,无论该样品是否进入创新医疗器械特别审批程序。
第二,允许注册人多点委托生产。注册人在获批首家生产后,可以再委托其他生产企业生产。
第三,允许本市受托生产企业提交委托方持有的医疗器械注册证申请生产许可。此举旨在鼓励具有专业化、规模化医疗器械研发制造能力的受托生产企业,进入医疗器械产业。
第四,允许住所或生产地址位于浦东新区内的医疗器械生产企业参照《试点工作实施方案》的要求,申请参加委托生产的试点工作。
根据上述《试点工作实施方案》,医疗器械注册申请人可以是医疗器械生产企业(包括集团公司)、研发机构和科研人员。
以上来自 上海市药监局官方网站,可参考下面链接中的内容,具体以相关制度为准。
权威解读:医疗器械注册人制度
相关新闻:
首个医疗器械注册人制度试点产品在上海上市


Comments | NOTHING