检测方法的总分析误差有3个主要来源:不精密度、方法特异性偏差、样品特异性偏差。方法学评价时通常只考虑前两者,样品特异性偏差常被认为与特定样品有关,不属于方法学的计量特征。但如果一种检测方法本身易收到某种干扰物质的影响,则干扰物质既可引起系统误差,也可引起偶然误差。因此诊断试验中分析特异性实验一般包括干扰和交叉反应研究。干扰实验一般可采用配对比对的方式,比较干扰样本和不包含或含正常浓度水平干扰物样本检测结果间差异。如果差异超出接受范围,再进一步研究该干扰物质的浓度水平。实施干扰实验基本上分为以下步骤:干扰物选择、干扰物的实验浓度、实验样本与对照样本选择与制备、确定干扰实验的接受标准。
一、 干扰物选择
干扰实验开始前应根据被评价方法的检测原理和预期用途列出可能引起干扰效果的物质清单。常见的可能产生干扰作用的物质有:
- 样本中的异常物质:高浓度的血红蛋白、胆红素、甘油三酯。 药物:常见处方与非处方药,接受某项目检测的特定病人群体中常用的药物。
- 代谢物:在特定病人群体中可能出现的异常生化代谢物与药物代谢物。
- 样本添加剂及在样本采集与处理过程中可与之接触的物质:抗凝剂(肝素、EDTA、柠檬酸盐、草酸盐等)与防腐剂(NaF、HCl、碘醋酸盐等),血清分离胶,样本采集容器及胶塞、导管、导管冲冼液、皮肤消毒剂、手部清洁剂、玻璃清洗液、手套粉未等。
- 文献中提及的对与被评价方法类似的其他方法有干扰作用的物质。 饮食:咖啡因、β-胡萝卜素、罂粟籽等。
二、 干扰物的实验浓度
进行干扰实验时干扰物的浓度可根据表1中的原则确定,常见可能内源性干扰物的建议实验浓度见《干扰实验指南》(WST 416-2013 干扰实验指南.pdf)附录C或CLSI-EP7-A2文件附录D(appendix D.Interference Test Concentrations for Endogenous Analytes),药物干扰物的建议实验浓度请参见有关文献。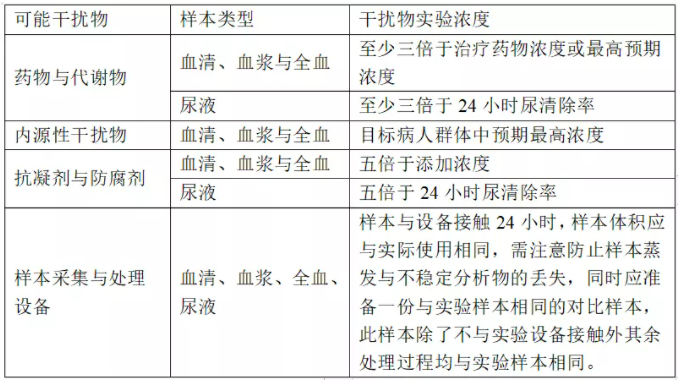
三、实验样本与对照样本制备
建议采用包含弱阳性样本在内的至少两个靶物质浓度水平的样本进行干扰研究。干扰实验样本形式可选择临床真实样本或采用人工添加干扰物的形式制备。以下为采用人工添加干扰物的形式制备方法:
1、基础样本
从未服用过药物的健康人群中采集新鲜标本(血清、尿液等),将标本混匀后即成为基础样本。
如新鲜标本难以取得,也可采用冰冻或冻干样本。但应注意这类样本中含有防腐剂与稳定剂或其他可能会对检测结果造成影响的成分。因此在应用此类样本之前应参照相应国家卫生行业标准对其基质效应进行评价。
确定基础样本中的被测量浓度,可通过添加纯分析物使样本中被测量浓度达到医学决定水平。
2、干扰物原液
干扰物质的纯品多为固体,需要用适当的溶剂将其溶解,制成干扰物原液。如所用的是药品级制品,应注意所含赋形剂、防腐剂、杀菌剂、抗氧化剂、着色剂、调味剂、金属氧化物、填充物等对检测结果造成的影响。
溶剂应使干扰物充分溶解且不会影响检测结果。常用溶剂有纯水、HCl 或NaOH溶液、乙醇或甲醇、丙酮、二甲基亚砜等。
原液浓度应至少20倍于实验浓度,以减少对基础样本基质的稀释。应注意防止有机溶剂的挥发并考虑其在水中的溶解度。
常见干扰物溶解方式见CLSI-EP7-A2文件附录G(AppendixG.Preparation of Test Solutions for Interferece Testing)。
3、实验样本与对照样本
以20倍于实验浓度的干扰物原液为例,实验样本与对照样本的制备方法见表2。注意样本制备时取样体积;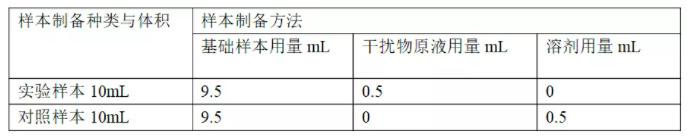
四、 确定干扰实验的接受标准
可结合产品的特点,设置合理的结果接受标准,并详述设定依据。对于可给出量值数据或计数结果的定性检测试剂,如OD值、Ct值,一般可依据产品预期用途、生物学变异等设定产品的可接受范围。
来源:小桔灯网


Comments | NOTHING