2002年,美国制药业认为FDA管得太严,使企业在生产过程中没有丝毫的灵活性。FDA考虑给予制药业一定的自治。但业界自治的前提是要让FDA了解所希望了解的东西,包括产品质量属性、工艺对产品的影响、变量的来源、关键工艺参数的范围,即我们平时所说的药品质量审评的范畴。作为制药业,要对产品质量属性有透彻的理解,要对工艺进行详实的科学研究,要对质量风险有科学的评估。更重要的是,要把这些研究信息与FDA共享,以增加FDA的信心。但是面对成千上万的药物主文件(DMF),由于FDA药品审评人员有限,以及这些有限的人力资源要用在现场cGMP认证现场检查上和突发事件处理上,因此,用于质量审评的人员数量非常有限。为了协调各方面的矛盾,一种全新的监管理念应运而生,它有利于药品监管人员、企业界和患者的三方共赢。于是,开始有了QbD理念。
质量源于设计,与其说是方法,还是不如说是意识,或者用现在流行语——思维方式的改变,学习QbD需要了解几个概念:
- 目标质量概况(QTTP),
- 也称目标产品质量概括Target Product Quality Profile,TPQP;
- 关键物质属性Critical Material Attribute,CMA;
- 关键质量属性(Critical Quality Attribute,CQA);
- 设计空间(Design Space):输入的变量(如物质属性等)和已被证明可提供质量保证的工艺参数的多维组合和相互作用。
- 试验设计(DOE)。
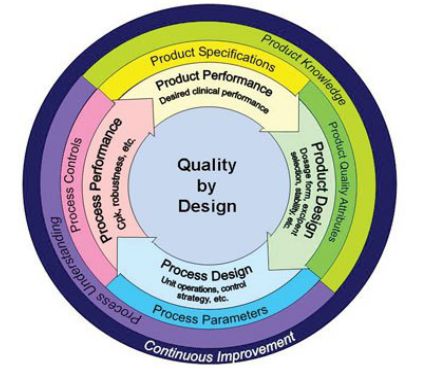
质量设计是以预先设定的目标产品质量概括(Target Product Quality Profile,TPQP)为研发的起点,在了解关键物质属性(Critical Material Attribute,CMA)的基础上,通过试验设计(Design of Experiments,DOE),理解产品的关键质量属性(Critical Quality Attribute,CQA),确立关键工艺参数(Critical Process Parameter,CPP),在原料特性、工艺条件、环境等多个影响因素下,建立能满足产品性能的且工艺稳健的设计空间(Design Space),并根据设计空间,建立质量风险管理,确立质量控制策略和药品质量体系(Product Quality System,PQS),整个过程强调对产品和生产的认识。QbD包括上市前的产品设计和工艺设计,以及上市后的工艺实施。
实施QbD的流程一般有以下5个步骤:
(1)确定产品的关键质量属性(Critical Quality Attributes,CQAs),包括理化性质、生物学特性及其他质量相关性质;
(2)利用风险分析,确定关键工艺参数(Critical Process Parameters,CPP)、起始物料属性与CQA之间的关系;
(3)开发出产品生产工艺的设计空间(Design Space);
(4)开发出控制策略(Control Strategy),形成控制空间(Control Space);
(5)大生产开始后,对生产过程进行实时检测和控制,持续改进工艺,保证质量的稳定性。
实施QbD五个关键因素:工艺理解,设计空间,生产设计,工艺改进和工艺异常。
简单地说,QbD就是在确定研究对象和想要达到目标的基础上,通过大量的处方筛选和工艺研究,找到影响处方和工艺的关键变量以及这些变量的变化范围,由此建立产品的质量体系。从数学角度上讲,QbD是原料、辅料、工艺和包装的函数。即原料药、辅料、工艺和包装都是自变量,药品质量是因变量。
中国制药技术《实施“质量源于设计”的五个关键因素》
1、 “质量源于设计”简介
质量源于设计(Quality by Design,QbD)这一理念首先出现在人用药品注册技术规定国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)发布的Q8中,其定义为“在可靠的科学和质量风险管理基础之上的,预先定义好目标并强调对产品与工艺的理解及工艺控制的一个系统的研发方法”。 ICH Q8指出,质量不是通过检验注入到产品中,而是通过设计赋予的。要获得良好的设计,必须增加对产品的认知和对生产的全过程控制。
实施QbD是将过程分析技术与风险管理综合应用于药品工艺开发的过程,它的目的不是消灭生产过程中的偏差,而是建立一种可以在一定范围内调节偏差来保证产品质量稳定性的生产工艺。通过QbD可以找出这个范围,并建立设计空间(Design Space)。ICH Q8对设计空间的定义为“已被证明有质量保障作用的物料变量和工艺参数的多维组合和相互作用”,就是各种影响产品质量的关键因素和参数的组合。设计空间允许企业在研究的基础上确定一个可以保证产品质量的操作空间。一旦确定产品生产的设计空间,则在此设计空间中的各种工艺等方面的变化,无需进行进一步的注册审批,减少上市后的变更申报。此点赋予了注册审批灵活而科学的管理方式。所以设计空间的建立和注册办法的简化是实施QbD的最终目的。
2、QbD的实施
目前人们对QBD的关注日益加深。在药品注册前期,许多公司对工艺研发阶段投入了更多的精力和资金进行研究,其目的是在研究中形成建立“设计空间”所需的科学基础(Knowledge Space),并从中找出存在于物料和生产工艺中的一系列变量。药品生产企业希望通过QBD的实施,减少药品生产的质量风险,减少生产成本,缩短投资回报时间。
2005年 7月开始,FDA就组织了一项CMC试点计划(Chemical Manufacture and Control Pilot Program),招募了9个企业的11个项目进行QbD注册申报试点,其中的9个项目已经通过了注册审批。 实际上,国内一些领先的企业已经开始了这方面作实践探索。海正药业对两个已经实施完的项目正运用QbD的方法进行探索性研究。上药集团信谊药厂为了申报海外注册,有两个项目运用了QbD。有资料表明,一个项目原来用传统方法一直不能稳定地控制质量,一次合格率低,采用QbD后,生产的50批产品,一次合格率达到了100%。所以长期来看,实施QbD可以有效的增加药品质量的合格率和质量稳定性,从而降低生产成本。
实施QbD的流程一般有以下5个步骤:
1)确定产品的关键质量属性(Critical Quality Attributes,CQAs),包括理化性质、生物学特性及其他质量相关性质;
2)利用风险分析,确定关键工艺参数(Critical Process Parameters,CPP)、起始物料属性与CQA之间的关系;
3)开发出产品生产工艺的设计空间(Design Space);
4)开发出控制策略(Control Strategy),形成控制空间(Control Space);
5)大生产开始后,对生产过程进行实时检测和控制,持续改进工艺,保证质量的稳定性。
在实施“质量源于设计”的时候,必须关注以下五个关键因素:工艺理解,设计空间,生产设计,工艺改进和工艺异常。
2.1工艺理解(Process Understanding)
QbD的理念中,产品的质量不是靠最终的检测来实现的,而是通过工艺设计出来的,这就要我们在生产过程中对工艺过程进行“实时质量保证”,保证工艺的每个步骤的输出都是符合质量要求的。
要实现“实时质量保证”,就必须在工艺开发的过程中确定关键工艺参数,并充分理解关键工艺参数的形成及其与产品关键质量属性的关系,即关键工艺参数是如何影响产品关键质量属性的。这样在大生产时,只要对关键工艺参数进行实时的监测和控制,保证关键工艺参数是合格的,就能保证产品质量达到要求。这就是FDA所说的“工艺理解”,其关键是确定CPP与CAQ并找出他们之间的关系。实现“工艺理解”需要从以下3个方面着手:
1)创造一种“不断改进”的文化,以获得足够的工艺理解。当有了对工艺的足够理解后,如果工艺发生了某种变更,就可以判断这种变更是不是在建立的设计空间之内。如果在“设计空间”内,就不需要对工艺的变更进行重新申请注册。
2)需要工艺开发人员与生产操作人员之间的合作。设计好的工艺在实际的生产运行中可能出现各种异常及偏差,而生产操作人员对出现这种意外情况的原因和对工艺的理解是不够的,这就需要已将掌握了所有工艺知识的研发人员来解决问题,并从中获得工艺改进的资料。这种合作能促进团队使用更好的practice、提高利润,提高在全国制药行业中的过程预见性和质量符合性。
3)先进技术的采用。要对CPP进行实时的监控,就必须采用比较先进的技术手段,如过程分析技术PAT(Process Analysis Technique)。
QbD形成的关键之一是工艺开发人员和生产人员之间的合作。在工艺注册之前,通过他们的合作可以获得对工艺的充分认识,并为注册文件中的CMC(Chemistry, Manufacturing and Controls)部分做准备。
一般而言,某种药物通过少量人体试验确定对人体无害后,工艺开发人员就开始了大生产工艺的研究。随着临床试验的进行和临床风险的减少,产品注册成功的概率增大,投资失败的概率降低,研究团队开始研发准备提交注册的商业化大生产工艺。在产品工艺开发初期,法规对工艺的调控是最低的。当进入到临床试验后,法规的调控不断增强,在最终商业大生产时达到最大,这时候任何工艺的改变都可能需要再注册。所以工艺开发为研究控制空间的理论基础和建立控制空间并进行试验提供了最好的机会,这样就可以最大限度的增加工艺和产品质量的稳定性与可预测性。一旦商业大生产开始了,这样的机会就减少了。
在商业大生产之前对工艺的理解越透彻,工艺开发和大生产之间技术转移的时间就会越短,这样投资回报的时间就越快。一种新药的机会成本是很大的,减少技术转移的时间就加快了投资回报的时间。在技术转移结束后,工艺开发的人员应该被召回去解决大生产中遇到的困难和问题,并积累对工艺的认识,不断改进工艺。
2.2设计空间(Design Space)
工艺开发得到的生产工艺可能具有多个控制空间(Control Space),不同的控制空间有不同的控制策略(Control Strategy),这些控制空间总称为知识空间(Knowledge Space)。ICH Q8对控制策略的定义为“源自于现行产品和工艺理解的一组规划过的控制,用于保证工艺性能和产品质量。这些控制可包括与原料药和药用物质及组份,设施和设备运行条件,过程控制,成品质量标准,和监控与控制的关联方法与频次相关的参数的属性”。控制策略是基于对工艺的风险分析与管理而建立的,它的目的是保证生产出的产品符合标准。对于一个产品的控制策略可以有很多种,比如在线测试、成品检验或实时放行检测。
在知识空间范围内,采用任何一种可能的控制空间都能生产出符合要求的产品。如图1所示,采用控制空间1和设计空间2都是符合要求的。
随着一个产品在生命周期中不断向后发展,由于生产规模扩大、经济效应和其他因素的影响,原来的控制策略可能会不足以满足生产的需要,这就需要改变工艺的控制策略,形成新的控制空间,即从“控制空间1”逐渐演变成“控制空间2”,如图1所示。确定新控制空间的科学依据通常来自于对实际大生产中对工艺中异常、偏差、事故的处理。
改变控制空间具有很高的风险。首先生产工艺在新的控制空间中运行之前,必须由相关部门审核批准。这是一个投入费用多、效率不高的过程,因为新工艺生产可能导致产品质量的变化,这样的话就需要进行新的临床研究,花费大量的时间和财力。其次,评估控制空间2的人员最好是当初评估控制空间1的那些人员,因为他们已经对工艺有了很深入的理解。然而,这些专家在控制空间1批准之后已经很难再聚集在一起了。
而根据ICH Q8,可以在对工艺进行注册之前,开发出“设计空间”,这个空间是通过对知识空间的风险分析与试验设计而取得的。这样的话,只要所有的控制空间都在设计空间的范畴内,那么控制策略在各个控制空间之间移动时,如材料的属性和工艺参数产生变化时,就不需要再进行注册,如图2所示。例如设计空间与生产规模或设备无关,在生产规模、设备或地点变更时就可能无需补充申请。这样企业就可以减少申报费用,节约时间,提高工艺改进的速度,最终达到增加利润的目的。
为了让注册审批人员更清楚地明白这样一个设计空间可以带来的好处,必须在提交的注册文件中清楚的写出建立设计空间的理论依据和实验结果。这些理论依据可以来自于实验设计(Design Of Experiment),用这些实验来确定和测试“预计设计空间”的外部界限,了解他们对产品的关键质量属性的影响,找出任何“新的控制空间”可能产生的关键工艺参数。这样,在技术转移和开始大生产的时候,才能够得到有关控制空间的数据并建立设计空间,保证大生产的顺利进行。
2.3生产设计(Design for Manufacturing)
由于控制空间和设计空间的开发是建立在工艺研发和生产制造小组先前的实验和产品知识上的,是小规模或中等规模的实验,其生产环境和商业生产有很大的不同,所以在大生产条件下所进行的实验对于设计下一步的工艺步骤具有指导意义。通过对大生产条件下的实验数据的收集、整理与分析,可以评估此时生产工艺的生产能力。通过分析评估,可以检测与识别CPP和CQA,加深对他们之间关系的理解,使商业化大生产的工艺得到更好的控制。
另一生产设计中使用到的数据来源,是在生产出现异常情况时收集的CPP与CQA的相关信息。这些生产上出现的异常和设计性大生产实验一样,也可以揭示出之前没有发现的关键工艺参数,这些参数的控制也需要通过设计实验进一步加以研究和控制。
因为这些关键工艺参数的信息通常隐藏在大量的数据中难以发现,或者因为缺少合作和持续改进的文化及相应的技术而不能及时的找出来,那么在设计一个大生产工艺时,可能会因为没有办法去收集这些数据或者无法对这些数据进行分析而导致没能有效的使用这些数据,错过改进工艺的机会。
2.4工艺改进(Process Improvement)
QbD的实施是团队努力对已有工艺改进的结果,工艺的改进最终增加了对工艺的理解,减少工艺的变异并实时保证质量。可以通过对不同部分的生产数据(如自动报告、工艺趋势、控制图)的分析来检测CQA的变化。如果检测到的CQA的变异来源不明,可以将其和标准做比较,使用过程能力分析(Process Capability Analyses)来判断此CQA的变异概率。
如果CQA的变异不在可接受的范围内,就要进行调查分析,找出原因并实施改进纠正措施。改进后的控制策略如果不在现有的控制空间内,那就会产生新的控制空间,新的控制空间最好在原有的设计空间内。
如果知道导致CQA产生变异的原因,可以使用现有的质量标准或操作规程对修改后的工艺进行测试,以证明新的控制策略达到了目标效果。
新的工艺测量方法可能需要更先进的能够对CQA进行在线实时检测的仪器。这些来自于PAT的实时检测数据具有“实施质量保证”的作用。通过控制图和其他类型的数据分析方法可以看出工艺是否处于有效的控制中。例如,过程监控、趋势图、过程能力分析都是常见的分析数据的方法。
2.5工艺异常(Process Upsets)
如果对工艺趋势的分析表明了CQA的变异已经得到了足够有效的控制,就不需要进行工艺改进。然而,实际大生产中工艺异常的出现是不可避免的。工艺异常就相当于在大生产规模下的实验,可能揭示出之前没有发现的关键参数,了解了这些后可以实施改进。工艺异常在开始大生产到真正实现“实时质量保证”这个时间段中,是不断在减少的。
3、实施QbD的好处
2004年,FDA发布PAT指南,标志着FDA已经促使着整个制药行业在生产过程中同时控制工艺中的变异,并实时保证产品质量。就是说,尽管生产中使用的物料和工艺过程有变异或偏差,但必须实时保证工艺输出的质量。换句话说,必须在生产工艺中设计并控制输出产品的质量,而不能通过最终的产品检测来保证质量。
成功的实施QbD可以解决只通过最终产品的检测来保证产品质量的问题,因为工艺的开发是建立在对产品关键质量属性、关键工艺参数之间关系的透彻理解的基础之上的,实时监测数据就具有实时质量保证作用,减少生产中偏差、变异的概率,减少不合格批次的产生,最终提高产品质量稳定性,减少由于不合格带来的损失。另一方面,在实际大生产中,对很多工艺参数的控制不能做到一成不变,但在申报生产工艺时,报的参数都是一个点。如果在实际生产中不能准确控制参数,就会产生报废、返工甚至弄虚作假的现象。设计空间允许企业在研究的基础上确定一个可以保证产品质量的操作空间。这样,对于监管部门和制药企业都是一个双赢的结果。


Comments | NOTHING