根据2015年103号公告《医疗器械生产质量管理规范附录体外诊断试剂》2.2 厂房与设施的要求(参考链接),大部分体外诊断试剂企业都建有洁净区(室)(以下统称洁净区)。洁净区需要周期性维护方能保持其能力,以符合法规的要求。对于洁净区的洁净程度保持能力的评价,我们通常采用定期(周期性)检测来证明。那检测周期或频次如何制定,可以兼顾合规性和经济性呢?
一、相关法规和标准
ISO14644.2 《为认证与ISO 14644-1连续的相符性的测试和监测技术要求》
GB50457-2008 《医药工业洁净厂房设计规范》(GB50457-2008)、
GB50591-2010 《洁净室施工及验收规范》
GB/T16292-2010 《医药工业洁净室(区)悬浮粒子的测试方法》
GB/T16293-2010 《医药工业洁净室(区)浮游菌的测试方法》
GB/T16294-2010 《医药工业洁净室(区)沉降菌的测试方法标准》
GB/T 36066-2018《洁净室及相关受控环境:检测技术分析与应用》
YY0033-2000 《无菌医疗器具生产管理规范》
《中华人民共和国药典》2015版
二、考察对象
需要制定的周期涉及到组件硬件性能和系统性能。
组件性能: 初效、中效压差,高效过滤的完整性、臭氧浓度(消毒组件以常见的臭氧发生器为例);
系统性能:空气悬浮粒子、浮游菌、沉降菌、表面微生物及物理参数(温度、相对湿度、换气次数、气流速度、压差、噪声等);
三、检测周期的讨论
如果有具体的法规或标准条款涉及的,可以按相应法规或标准执行;如果没有,可以参考验证周期的判断:采用风险分析和历史检测数据初定一个周期,后续持续的周期性评价以及调整。
目前医疗器械和体外诊断生产质量管理规范均未规定具体的检测周期或频次,涉及的标准(如上)多为为测试方法和标准。具体有周期性内容的,反而是“老古董”YY0033:2000《无菌医疗器具生产管理规范》(无菌GMP已经生效了,为啥老古董还没作废,另做讨论)的附录C有这方面规定,现摘抄如下: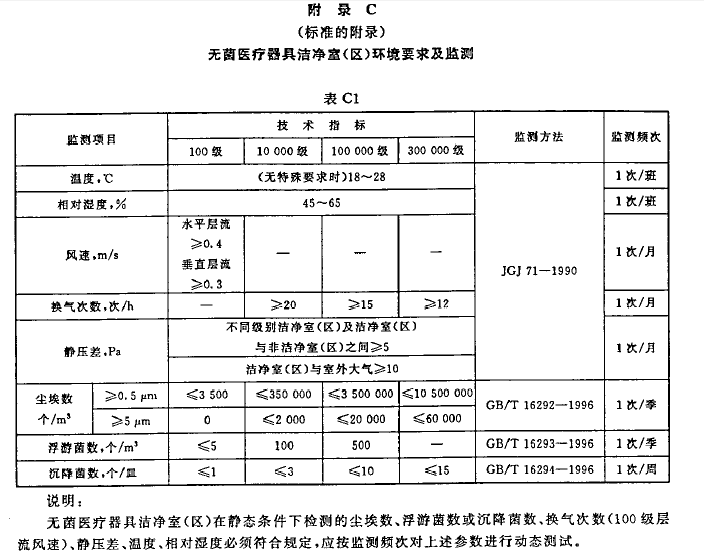
另外,《中国药典》9205 药品洁净实验室微生物监测和控制指导原则中也有类似的要求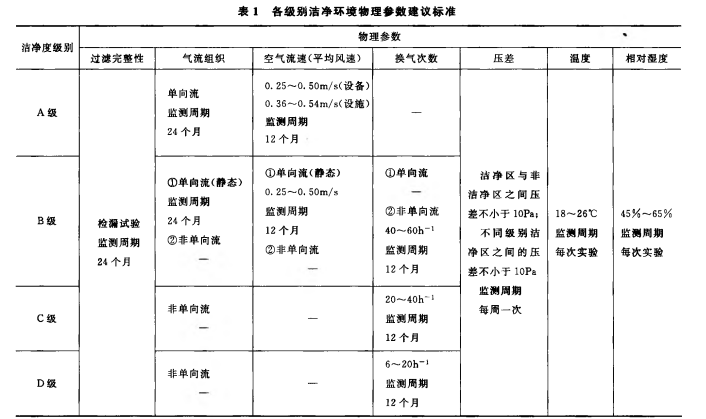

2019-10-28补充
GB50457《医药工业洁净厂房设计规范》附录B 医药洁净室(区)的维护管理 章节中也有推荐监测频次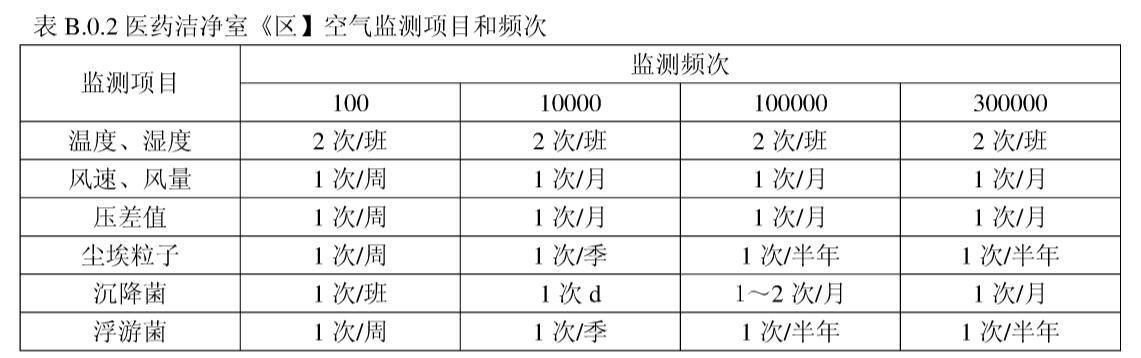
以十万级(药典中药品D级)为例
| \ | GB50473:2008 | 药典2015版9205 | YY0033:2000 |
|---|---|---|---|
| 温度、湿度 | 2次/班 | 1次/实验 | 1次/班 |
| 风速、风量 | 1次/月 | 1次/年 | 1次/月 |
| 压差值 | 1次/月 | 1次/周 | 1次/月 |
| 尘埃粒子数 | 1次/半年 | 1次/半年 | 1次/季 |
| 沉降菌 | 1-2次/月 | 1次/半年 | 1次/周 |
| 浮游菌 | 1次/半年 | 1次/半年 | 1次/季 |
| 过滤完整性 | - | 次/2年 | -- |
| 备注 | - | D级 | - |
无论GB50473,还是药典和YY0033无菌器械,对各个项目的监测频次还是有一定差异,这主要是适用产品不一致。尴尬的是体外诊断试剂的产品一般都不是无菌产品,也不是传统意义上的药品(虽然同属于“大药品”概念内),所以不论GB50473、YY0033,还是中国药典,都是他们的直接适用范围;而如果完全引用执行的话,又觉得资源方面存在一定的‘浪费’。
建议:可以按验证工作思路,根据产品特性,进行风险分析和检测数据回顾,自定义周期。
四、延伸
大家有兴趣可以查查PDA和ISPE,这两个组织也有相应的推荐,欢迎一起来讨论。


Comments | NOTHING