上周五(12月13日),CMDE公布了关于公开征求《真实世界数据用于医疗器械临床评价技术指导原则(征求意见稿)》意见的通知,引入一个相对比较前沿的概念——“真实世界”数据。这个真实世界是个何物?
真实世界数据是指来自现实医疗环境的、传统临床试验以外的数据,反映实际诊疗中患者健康状况和医疗服务过程。围绕相关科学问题,综合运用流行病学、生物统计学、循证医学等多学科方法技术,利用真实世界数据开展的研究统称为真实世界研究。
最近几年真实世界研究(Real World Study, RWS)实在是红热地发紫。不管是临床医生、还是生物统计师、还是药企们,都似乎在说它是21世纪的临床研究最好的方法。它将取代"RCT",成为临床研究第一方法。2019年4月4日,FDA基于真实世界数据(RWD, real world data)批准了辉瑞的爱博新(Ibrance)一项新适应症:与芳香化酶抑制剂或氟维司群(fulvestrant)联合,可用于治疗患有HR +、HER2-转移性乳腺癌的男性患者。
从现代科学发展角度上讲, 真实世界起源于实用性随机对照试验( practical random-ized control trials, PRCT)。在过去50年里,医学领域非常重视随机对照试验,特别是解释性随机对照试验( explanatory randomized control trials ,ERCT)。ERCT提供“理想”环境下干预的结果信息,临床医生应用这些研究结果之前还需要进一一步的研究。ERCT往往关注在严格控制医疗环境下治疗措施的效力,研究结果的外推性相对不佳,无法提供足够的证据并充分支持真实临床实践。为了克服ERCT的上述缺点,研究人员开始设计和实施PRCT,目的是获取可直接应用于真实临床实践的证据,PRCT可提供有关“真实世界”环境下干预的结局信息,其研究结果可以直接拿来应用,这可以说是真实世界的雏形。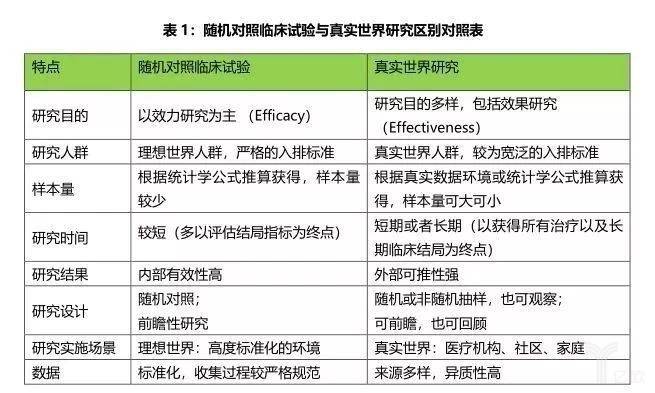
自真实世界研究的概念出现以来,在欧洲和北美,研究人员和相关组织陆续开展了一些真实世界研究,进行了大量独立的临床研究实践探索,如美国马萨诸塞大学医学院于1999年发起的急性冠脉事件全球注册研究(global registy of acute coronary events, GRACE)中,Mseselo等组织了-项真实世界研究,以评价胆碱酯酶抑制剂治疗诊断为轻度至中度阿尔茨海默病的中老年门诊患者的有效性和安全性。2009年8月,比较效益研究(comparative effectiveness research, CER)正式兴起,当时美国以法案形式将CER写入《美国复苏与再投资法案》,并计划投入11亿美元开展CER研究。在美国总统奥巴马签署法案后,美国相关负责机构,如美国国立卫生研究院(National Institutes of Health, NIH)和美国医疗保健研究与质量局( The Agency for Healthcare Research and Quality, AHRQ)立即着手CER的研究计划论证以及实施部署工作。真实世界研究并逐渐上升至国家宏观政策支持发展的高度。
2016年,美国国会已通过《21世纪治愈法案》(21st Century Cures Act),法案明确FDA可在合适情况下使用真实世界数据(Real-World Data, RWD),作为医疗器械及药品上市后研究及新适应证开发的审批证据。
2017年7月27日美国食品药品监督管理局(FDA)发布《采用真实世界证据支持医疗器械的法规决策》草案,2017年8月31日发布了最新版,该指南被认为是FDA对真实世界证据(RWE)用于医疗器械法规决策的表态。
国内情况:
国家药品监督管理局(NMPA,原CFDA)于2017年10月8日出台了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提到为满足临床急需药品医疗器械使用需求,加快审评审批,允许可附带条件批准上市,上市后按要求开展补充研究,此类补充研究可部分归属于RWS范畴。
2018年8月,吴阶平医学基金会和中国胸部肿瘤研究协作组共同整理的《中国真实世界研究指南(2018年版)》对RWS给出了最为全面的解释和说明。
2019年5月,国家药品监督管理局药品审评中心(CDE)发布《真实世界证据支持药物研发的基本考虑(征求意见稿)》,明确真实世界证据在药物研发中的地位和适用范围,并将探究真实世界证据的评价原则,以期为工业界利用真实世界证据支持药物研发提供科学可行的指导意见。
2019年12月13日CMDE发布了关于公开征求《真实世界数据用于医疗器械临床评价技术指导原则(征求意见稿)》意见的通知。
参考微信公众号:医学论文与统计分析、动脉网
其它参考:思宇医械观察 真实世界研究指南2018年版


Comments | NOTHING